Тракторы Buhler Versatile (Бюлер Версатайл) ТТХ, модели 305, 2375, 535
Производством тракторов, зерноуборочных комбайнов, самоходных опрыскивателей и прочих сельхозмашин компания Versatile занимается более 70 лет. Сегодня мощная полноприводная техника выпускается на заводах в США, Канаде, России.
Несмотря на такое разнообразие продукции, самым востребованным агрегатом бренда остается трактор Versatile, способный работать в различном климате. Весь модельный ряд этих сельхозмашин отличается высокой производительностью, качеством сборки, продуманностью конструкции, надежностью.
Содержание
- 1 Модельный ряд тракторов Верстайл
- 1.1 Универсальный трактор Версатайл 280
- 1.2 Производительный тягач 305
- 1.3 Универсальная модель 535
- 1.4 Трактор Buhler 2375
Бренд Versatile не просто выпускает продуктивные тракторы, но и постоянно работает над их усовершенствованием. За счет применения новейших технологий, инженерных разработок и материалов модельный ряд сельхозмашин постоянно пополняется новыми изделиями, технические характеристики которых позволяют задействовать их для посевных работ, обработки земли, погрузки и транспортировки урожаев, удобрений, стройматериалов.
Все трактора Бюлер, независимо от мощности и теххарактеристик, оснащены комфортабельной просторной кабиной с панорамным обзором во все 4 стороны, удобными информативными приборами, регулируемой рулевой колонкой, пневматической подвеской кресла (для удобства оператора). Далее рассмотрим модели наиболее востребованным в фермерских хозяйствах и на сельхозпредприятиях.
Универсальный трактор Версатайл 280
Полноприводная спецтехника с мощным шестицелиндровым двигателем 280 л.с. годится для любых сложных задач. Оснащена полуавтоматической трансмиссией 24/24, хорошей шумоизоляцией. Агрегат с электронным контролем работы мотора может работать и на биотопливе. Причем топливо впрыскивается в двигатель под большим давлением.
Комлектация Versatile 280, в дополнение к стандартной комплектации:
- Колеса задние 71070 R38
- Колеса передние 60065 R28
- Передний мост Ultrasteer (уменьшенный радиус разворота 2,1 м)
- Подогреватель блока двигателя 220В
- Кронштейн противовесов Ultrasteer
- Передние грузы 16шт х 110кг
- Задние грузы 2шт х 200кг (на колесах)
- Передние крылья 620 мм
- Комплект внешних зеркал Deluxe
- 3х точечная навеска
Производительный тягач 305
Этот трактор Бюлер обладает качественной гидравликой, мощным двигателем и надежной двенадцатиступенчатой трансмиссией. В зависимости от характера местности развивает скорость до 35 км/ч и одинаково эффективно эксплуатируется в любое время года.
В зависимости от характера местности развивает скорость до 35 км/ч и одинаково эффективно эксплуатируется в любое время года.
Вес трактора – порядка 15 тонн. Versatile 305 обладает автоматической коробкой передач и классической компоновкой, задние колеса – спаренные. Это универсальная машина, которая может использоваться круглый год и на любых работах.
Универсальная модель 535
Эта модель с 15-литровым мотором и вместительным топливным баком (1325 л.) может оборудоваться автоматической или механической трансмиссией.
- Запас крутящего момента, % — 35
- Производительность гидравлики, л/мин стандарт (опция) — 208 (303)
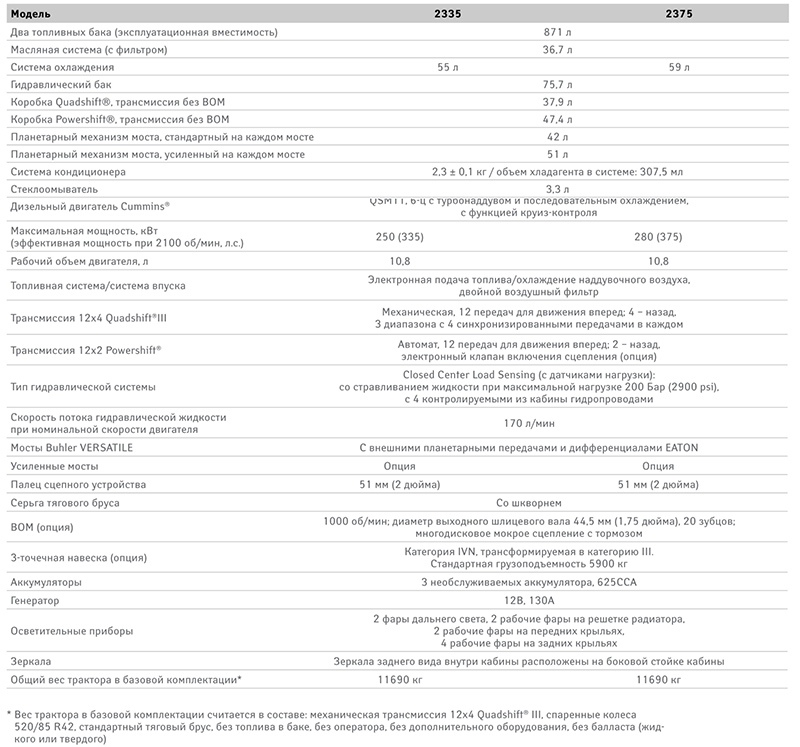
Трактор Buhler 2375
Он подходит для эксплуатации в небольших фермерских хозяйствах и на значительных участках. Тягач годится для перемещения грузов, урожая и тяжелых широкозахватных прицепов по полям, трассам. Оснащен мощным двигателем с электронным управлением, электронной системой подачи топлива и механической трансмиссией 12/4.
Все возможные проблемы с трактором легко устраняются за счет доступности узлов и простоты ремонта.
- Двигатель Дизельный Cummins QSM 11, рядный 6-циллиндровый, с турбонаддувом и последовательным охлаждением, с функцией круиз-контроля
- Мощность двигателя, кВт (эффективная мощность при 2100 об/мин., л. с. ) 250 (335) 280 (375)
- Рабочий объем двигателя, л. 10.8
- Топливная система / система впуска Электронная подача топлива / охлаждение надувочного воздуха, двойной воздушный фильтр
- Трансмиссия 12х4 Quadshift III— механическая, 12 передач для движения вперед; 4-назад, 3 диапазона с 4 синхронизаторами передачи в каждом
- Тип гидравлической системы Closed Center Load Sensing (с датчиком нагрузки): со стравливанием жидкости при максимальной нагрузке 200 Бар, с 4 контролируемыми из кабины гидроприводами
|
|
|
содержание .
A. Сухой вес трактора Предполагается, что сухой вес трактора включает механическую коробку передач 12 x 4 Quad Shift III, Размер шины 2375 Вес передней оси 5923,6 кг (13059 фунтов) Вес задней оси 2624,1 кг (5785 фунтов) A. Общий сухой вес трактора 8547,6 кг (18844 фунтов) B. Вес колес В следующей таблице приведены значения веса шины, трубы, обода колеса и прокладки (для двой- и задней осей и общего веса по конфигурации. Размер шины Конфигурация Передняя ось кг Задняя ось кг Общий вес колес кг 20,8 R38 R1W радиал. Одинарн. – Барабан 654,5 654,5 1309,1 20,8 R42 R1W радиал. Одинарн. – Барабан 720,9 720,9 1442,3 700/65 R38 R1 8 Послойн. Одинарн. – Барабан 936,2 936,2 1872,5 710/70 R38 R1 радиал. Одинарн. – Барабан 927,2 927,2 1854,3 710/70 R38 R1W радиал. Одинарн. – Барабан 1012,7 1012,7 2025,5 750/65 R38 R1 8 Послойн. Одинарн. – Барабан 1400,9 1400,9 2801,8 850/60 R38 R1 8 Послойн. Одинарн. – Барабан 1670 1670 3340 20,8 R38 R1W радиал. Двойн. – Барабан 1478,2 1478,2 2956,4 700/65 R38 R1 8 Послойн. Двойн. – Барабан 2108,2 2108,2 4216,4 710/70 R38 R1 радиал. Двойн. – Барабан 2094,7 2094,7 4189,4 710/70 R38 R1W радиал. Двойн. – Барабан 4894 4894 9788 750/65 R38 R1 8 Послойн. Двойн. – Барабан 2620 2620 5240 850/60 R38 R1 8 Послойн. Двойн. – Барабан 2997,3 2997,3 5994,4 20,8 R42 R1 радиал. Двойн. – Барабан 1521,4 1521,4 3043,8 20,8 R42 R1 радиал.** Двойн. – Барабан 1605,3 1605,3 3210,6 20,8 R42 R1W радиал. Двойн. – Барабан 1630,5 1630,5 3260,9 20,8 R42 R2 радиал. Двойн. – Барабан 1775,5 1775,5 3551,0 520/85 R42 R1W радиал. Двойн. – Барабан 1651 1651 3302 900/50 R42 R1W радиал. Двойн. – Барабан 2926 2926 5851 18,4 R46 R1 радиал.*** Двойн. – Барабан 1586,2 1586,2 3172,5 18,4 R38 R1 6 Послойн. Двойн. – Барабан для про- пашных культур 1136,3 1136,3 2272,5 РОСТСЕЛЬМАШ Агротехника Профессионалов Технические характеристики 7-8 2375 10/2016 В следующей таблице приведены значения веса шины, трубы, обода колеса и прокладки (для двойной Размер шины Конфигурация Передняя ось кг Задняя ось кг Общий вес колес кг 18,4 R38 R1 радиал.* Двойн. – Барабан для пропашных культур 1294,6 1294,6 2589,1 18,4 R42 R1 8 Послойн. Двойн. – Барабан для пропашных культур 1279,2 1279,2 2558,8 18,4 R42 R1 радиал.** Двойн. – Барабан для пропашных культур 1425,7 1425,7 2851,3 18,4 R46 R1 радиал.*** Двойн. – Барабан для пропашных культур 1624,3 1624,3 3248,7 20,8 R42 R1 10 Послойн. Тройн. – Барабан 2512,0 2512,0 5024,1 20,8 R42 R1 радиал. Тройн. – Барабан 2638,1 2638,1 5276,2 20,8 R42 R2 радиал.** Тройн. – Барабан 2893,6 2893,6 5787,3 520/85 R42 R1W радиал. Тройн. – Барабан 2703 2703 5407 18,4 R46 R1 радиал. Тройн. – Барабан 2665 2665 5330 РОСТСЕЛЬМАШ Агротехника Профессионалов Технические характеристики 7-9 2375 10/2016 |
Гены диапазона хозяев поксвируса и спектр вирус-хозяин: критический обзор
1. Международный комитет по таксономии вирусов — Таксономия. [(по состоянию на 1 июля 2017 г.)]; Доступно на сайте: https://talk.ictvonline.org/taxonomy/w/ictv-taxonomy
2. Феннер Ф., Хендерсон Д.А., Арита И., Езек З., Ладный И.Д. Оспа и ее искоренение. 1-е изд. Всемирная организация здравоохранения; Женева, Швейцария: 1988. стр. 1371–1409. [Google Scholar]
3. Тев К., Биаджини П., Кружези Э. Новое открытие оспы. клин. микробиол. Заразить. 2014;20:210–218. дои: 10.1111/1469-0691.12536. [PubMed] [CrossRef] [Google Scholar]
клин. микробиол. Заразить. 2014;20:210–218. дои: 10.1111/1469-0691.12536. [PubMed] [CrossRef] [Google Scholar]
4. Хендерсон Д.А. Ликвидация оспы — обзор прошлого, настоящего и будущего. вакцина. 2011;29:7–9. doi: 10.1016/j.vaccine.2011.06.080. [PubMed] [CrossRef] [Google Scholar]
5. Эссбауэр С., Пфеффер М., Мейер Х. Зоонозные поксвирусы. Вет. микробиол. 2010; 140: 229–236. doi: 10.1016/j.vetmic.2009.08.026. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Kroon E.G., Mota B.E.F., Abrahão J.S., da Fonseca F.G., de Souza Trindade G. Зоонозный бразильский вирус коровьей оспы: от поля к терапии. Антивир. Рез. 2011;92: 150–163. doi: 10.1016/j.antiviral.2011.08.018. [PubMed] [CrossRef] [Google Scholar]
7. Стэнфорд М.М., Макфадден Г. «Супервирус»? Уроки поксвирусов, экспрессирующих IL-4. Тренды Иммунол. 2005; 6: 339–345. doi: 10.1016/j.it.2005.04.001. [PubMed] [CrossRef] [Google Scholar]
8. Castrucci M.R., Facchini M., Di Mario G., Garulli B. , Sciaraffia E., Meola M., Fabiani C., De Marco M.A., Cordioli P., Сиккарди А. и др. Модифицированный вирус коровьей оспы Анкара, экспрессирующий гемагглютинин пандемии (h2N1) 2009 г.индуцирует перекрестный защитный иммунитет против евразийского «птичьего» вируса свиней h2N1 у мышей. Грипп Другие Респир. Вирусы. 2014; 8: 367–375. doi: 10.1111/irv.12221. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Sciaraffia E., Meola M., Fabiani C., De Marco M.A., Cordioli P., Сиккарди А. и др. Модифицированный вирус коровьей оспы Анкара, экспрессирующий гемагглютинин пандемии (h2N1) 2009 г.индуцирует перекрестный защитный иммунитет против евразийского «птичьего» вируса свиней h2N1 у мышей. Грипп Другие Респир. Вирусы. 2014; 8: 367–375. doi: 10.1111/irv.12221. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Гарсия-Арриаза Дж., Сепеда В., Халленгард Д., Сорцано К.О., Кюммерер Б.М., Лильестрём П., Эстебан М.А. Новая вакцина на основе поксвируса MVA-CHIKV обладает высокой иммуногенностью и защищает мышей от инфекции чикунгуньи. Дж. Вирол. 2014;88:3527–3547. doi: 10.1128/ОВИ.03418-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Чан В.М., Рахман М.М., Макфадден Г. Вирус онколитической миксомы: путь в клинику. вакцина. 2013; 31:4252–4258. doi: 10.1016/j.vaccine.2013.05.056. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Мосс Б. Репликация ДНК поксвируса. Харб Колд Спринг. Перспектива. биол. 2013;5:a010199. doi: 10.1101/cshperspect.a010199. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мосс Б. Репликация ДНК поксвируса. Харб Колд Спринг. Перспектива. биол. 2013;5:a010199. doi: 10.1101/cshperspect.a010199. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Лефковиц Э.Дж., Ван С., Аптон С. Поксвирусы: прошлое, настоящее и будущее. Вирус рез. 2006; 117:105–118. doi: 10.1016/j.virusres.2006.01.016. [PubMed] [CrossRef] [Академия Google]
13. Тульман Э.Р., Афонсо К.Л., Лу З., Жсак Л., Кутиш Г.Ф., Рок Д.Л. Геном вируса оспы канареек. Дж. Вирол. 2004; 78: 353–366. doi: 10.1128/ОВИ.78.1.353-366.2004. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
14. Гюнтер Т., Хаас Л., Алави М., Вольсейн П., Маркс Дж., Грундхофф А., Бехер П., Фишер Н. Восстановление первой полноразмерной последовательности генома парапоксвируса непосредственно из клинического образца. науч. 2017;7:3734. doi: 10.1038/s41598-017-03997-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Хьюз А.Л., Фридман Р. Эволюция генома поксвируса путем приобретения и потери генов. Мол. Филогенет. Эвол. 2005; 35: 186–195. doi: 10.1016/j.ympev.2004.12.008. [PubMed] [CrossRef] [Google Scholar]
Мол. Филогенет. Эвол. 2005; 35: 186–195. doi: 10.1016/j.ympev.2004.12.008. [PubMed] [CrossRef] [Google Scholar]
16. Братке К.А., Маклисагт А. Идентификация множественных независимых горизонтальных переносов генов в поксвирусы с использованием сравнительного геномного подхода. БМС Эвол. биол. 2008; 8:67. дои: 10.1186/1471-2148-8-67. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. McLysaght A., Baldi P.F., Gaut B.S. Обширный набор генов, связанный с адаптивной эволюцией поксвирусов. проц. Натл. акад. науч. США. 2003; 100:15655–15660. doi: 10.1073/pnas.2136653100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Макфадден Г. Тропизм поксвируса. Нац. Преподобный Микробиолог. 2005; 3: 201–213. doi: 10.1038/nrmicro1099. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Haller S.L., Peng C., McFadden G., Rothenburg S. Поксвирусы и эволюция диапазона хозяев и вирулентности. Заразить. Жене. Эвол. 2014;21:15–40. doi: 10. 1016/j.meegid.2013.10.014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1016/j.meegid.2013.10.014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Братке К.А., Маклисагт А., Ротенбург С. Обзор генов диапазона хозяев в геномах поксвирусов. Заразить. Жене. Эвол. 2013; 14:406–425. doi: 10.1016/j.meegid.2012.12.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Werden S.J., Rahman M.M., McFadden G. Гены диапазона хозяев поксвируса Глава 3. Adv. Вирус рез. 2008; 71: 135–171. [PubMed] [Google Scholar]
22. Chen W., Drillien R., Spehner D., Buller R.M. Исследование in vitro и in vivo гомолога вируса эктромелии гена диапазона хозяина вируса осповакцины K1L. Вирусология. 1993; 196: 682–693. doi: 10.1006/viro.1993.1525. [PubMed] [CrossRef] [Google Scholar]
23. Stern R.J., Thompson J.P., Moyer R.W. Аттенуация мутантов B5R вируса кроличьей оспы in vivo связана с нарушением роста, а не с усилением воспалительной реакции хозяина. Вирусология. 1997;233:118–129. doi: 10.1006/viro.1997.8556. [PubMed] [CrossRef] [Google Scholar]
24. Liu J., Wennier S., Moussatche N., Reinhard M., Condit R., McFadden G. Вирус миксомы M064 — новый член суперсемейства C7L поксвирусов Факторы диапазона хозяев, контролирующие кинетику миксоматоза у европейских кроликов. Дж. Вирол. 2012; 86: 5371–5375. doi: 10.1128/ОВИ.06933-11. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Liu J., Wennier S., Moussatche N., Reinhard M., Condit R., McFadden G. Вирус миксомы M064 — новый член суперсемейства C7L поксвирусов Факторы диапазона хозяев, контролирующие кинетику миксоматоза у европейских кроликов. Дж. Вирол. 2012; 86: 5371–5375. doi: 10.1128/ОВИ.06933-11. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Damon I.K. Поксвирусы. В: Knipe DM, Howley PM, редакторы. Вирусология Филдса. 6-е изд. Том 2. Липпинкотт, Уильямс и Уилкинс; Филадельфия, Пенсильвания, США: 2014. с. 2160. [Google Scholar]
26. Trindade G.S., Emerson G.L., Sammons S., Frace M., Govil D., Mota B.E.F., Abrahão J.S., de Assis F.L., Olsen-Rasmussen M., Goldsmith C.S., et al. Вирус Serro 2 подчеркивает основные геномные и биологические особенности природного вируса коровьей оспы, заражающего людей. Вирусы. 2016;8:328. doi: 10.3390/v8120328. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
27. Альжанова Д., Фрю К. Модуляция иммунного ответа хозяина вирусом коровьей оспы. микробы заражают. 2010;12:900–909. doi: 10.1016/j.micinf.2010.07.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
микробы заражают. 2010;12:900–909. doi: 10.1016/j.micinf.2010.07.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Chen X., Anstey A.V., Bugert J.J. Заражение вирусом контагиозного моллюска. Ланцет Инфекция. Дис. 2013; 10: 877–888. doi: 10.1016/S1473-3099(13)70109-9. [PubMed] [CrossRef] [Google Scholar]
29. Феннер Ф. Приключения с поксвирусами позвоночных. ФЭМС микробиол. 2000; 24:123–133. doi: 10.1111/j.1574-6976.2000.tb00536.x. [PubMed] [CrossRef] [Google Scholar]
30. Афонсо К.Л., Тульман Э.Р., Лу З., Ома Э., Кутиш Г.Ф., Рок Д.Л. Геном энтомопоксвируса Melanoplus sanguinipes. Дж. Вирол. 1999;73:533–552. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Thézé J., Takatsuka J., Li Z. New Insights in the Evolution Entomopoxvirinae из полных геномных последовательностей четырех энтомопоксвирусов, заражающих Adoxophyes honmai , Choristoneura biennis , Choristoneura rosaceana и Mythimna separata . Дж. Вирол. 2013; 87: 7992–8003. doi: 10.1128/ОВИ.00453-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Вирол. 2013; 87: 7992–8003. doi: 10.1128/ОВИ.00453-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Thézé J., Takatsuka J., Nakai M., Arif B., Herniou E.A. Конвергенция приобретения генов между энтомопоксвирусами и бакуловирусами. Вирусы. 2015;7:1960–1974. дои: 10.3390/v7041960. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Бейкер К.С., Леггетт Р.М., Бексфилд Н.Х., Алстон М., Дейли Г., Тодд С., Тачеджян М., Холмс С.Е., Крамери С. , Ван Л.Ф. Метагеномное исследование вирусов африканских фруктовых летучих мышей соломенного цвета: обнаружение поксвируса рукокрылых и выделение нового аденовируса. Вирусология. 2013; 441:95–106. doi: 10.1016/j.virol.2013.03.014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вспышка тяжелой зоонозной вирусной инфекции коровьей оспы на юго-востоке Бразилии. Эмердж. Заразить. Дис. 2015;21:695–698. doi: 10.3201/eid2104.140351. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вирус коровьей оспы в домашних условиях во время вспышки осповакцины крупного рогатого скота, Бразилия. Эмердж. Заразить. Дис. 2013;19:2045–2047. doi: 10.3201/eid1912.120937. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эмердж. Заразить. Дис. 2013;19:2045–2047. doi: 10.3201/eid1912.120937. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Нолен Л.Д., Осадебе Л., Катомба Дж., Ликофата Дж., Мукади Д., Монро Б., Доти Дж., Хьюз С.М., Кабамба Дж., Малекани Дж. Расширенная передача инфекции от человека к человеку во время вспышки обезьяньей оспы в Демократической Республике Конго. Эмердж. Заразить. Дис. 2016;22:1014–1021. doi: 10.3201/eid2206.150579. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Campe H., Zimmermann P., Glos K., Bayer M., Bergemann H., Dreweck C., Graf P., Weber B.K., Мейер Х., Бюттнер М. Передача вируса коровьей оспы от домашних крыс человеку, Германия. Эмердж. Заразить. Дис. 2009; 15: 777–780. doi: 10.3201/eid1505.0
. [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]38. Щелкунов С.Н. Возрастающая опасность зоонозных ортопоксвирусных инфекций. PLoS Патог. 2013;9:1–4. doi: 10.1371/journal.ppat.1003756. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Mayr A., Mahnel H. Характеристика вируса оспы птиц, выделенного от носорога. Арка Gesamte Virusforsch. 1970; 31: 51–60. doi: 10.1007/BF01241665. [PubMed] [CrossRef] [Google Scholar]
Mayr A., Mahnel H. Характеристика вируса оспы птиц, выделенного от носорога. Арка Gesamte Virusforsch. 1970; 31: 51–60. doi: 10.1007/BF01241665. [PubMed] [CrossRef] [Google Scholar]
40. Чжао Г., Друа Л., Теш Р.Б., Попов В.Л., Литтл Н.С., Аптон С., Вирджин Х.В., Ван Д. Геном вируса оспы Йока. Дж. Вирол. 2011;85:10230–10238. doi: 10.1128/ОВИ.00637-11. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Еще одна часть экологической головоломки VACV: могут ли домашние грызуны быть связующим звеном между дикой природой и вспышками осповакцины крупного рогатого скота в Бразилии? ПЛОС ОДИН. 2009 г.;4:7428. doi: 10.1371/journal.pone.0007428. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Hutson C.L., Nakazawa Y.J., Self J., Olson V.A., Regnery R.L., Braden Z., Weiss S., Malekani J., Jackson E. , Тейт М. Лабораторные исследования африканских сумчатых крыс (Cricetomys gambianus) как потенциальных видов-хозяев-резервуаров вируса оспы обезьян. PLoS Негл. Троп. Дис. 2015; 9:1–20. doi: 10.1371/journal.pntd.0004013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS Негл. Троп. Дис. 2015; 9:1–20. doi: 10.1371/journal.pntd.0004013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Вильяреал Л.П., Дефилиппис В.Р., Готлиб К.А. Острые и стойкие вирусные жизненные стратегии и их связь с возникающими заболеваниями. Вирусология. 2000; 272:1–6. doi: 10.1006/viro.2000.0381. [PubMed] [CrossRef] [Google Scholar]
44. Молдин М., Антверпен М., Эмерсон Г., Ли Ю., Зоеллер Г., Кэрролл Д., Мейер Х. Вирус коровьей оспы: что в имени? Вирусы. 2017;9:101. doi: 10.3390/v9050101. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
Б.П. Естественная вирусная инфекция коровьей оспы: диагностика, выделение и характеристика. Курс. протокол микробиол. 2016; 42:14A.5.1–14A.5.43. [Академия Google]
46. Нинов Л., Домарт Ю., Вервел С., Войно С., Салез Н., Рауль Д., Мейер Х., Чапек И., Зандотти С., Чаррел Р.Н. Передача вируса коровьей оспы от домашних крыс людям, Франция. Эмердж. Заразить. Дис. 2009; 15: 781–784. doi: 10. 3201/eid1505.0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3201/eid1505.0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Рейнольдс М.Г., Кэрролл Д.С., Олсон В.А., Хьюз С., Галлей Дж., Ликос А., Монтгомери Дж., Суу-Ире Р., Кваси М.О., Рут Дж.Дж. Тихая энзоотика ортопоксвируса в Гане, Западная Африка: доказательства участия нескольких видов при отсутствии широко распространенного заболевания человека. Являюсь. Дж. Троп. Мед. Гиг. 2010; 82: 746–754. дои: 10.4269/ajtmh.2010.09-0716. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Hutson C.L., Lee K.N., Abel J., Carroll D.S., Montgomery J.M., Olson V.A., Li Y., Davidson W., Hughes C., Диллон М. и др. Зоонозные ассоциации оспы обезьян: результаты лабораторной оценки животных, связанных со вспышкой в нескольких штатах США. Являюсь. Дж. Троп. Мед. Гиг. 2007; 76: 757–768. [PubMed] [Google Scholar]
49. Bowman K.F., Barbery R.T., Swango L.J., Schnurrenberger P.R. Кожная форма папулезного стоматита крупного рогатого скота у человека. ДЖАМА. 1981;246:2813–2818. doi: 10.1001/jama.1981.03320240021018. [PubMed] [CrossRef] [Google Scholar]
1981;246:2813–2818. doi: 10.1001/jama.1981.03320240021018. [PubMed] [CrossRef] [Google Scholar]
. Коинфекция вируса осповакцины человека и вируса псевдокоровьей оспы: клиническое описание и филогенетическая характеристика. Дж. Клин. Вирол. 2010;48:69–72. doi: 10.1016/j.jcv.2010.02.001. [PubMed] [CrossRef] [Google Scholar]
51. Люн А.К., Баранкин Б., Достопочтенный К.Л. Контагиозный моллюск: обновление. Недавний Пэт. Воспаление. Препарат от аллергии Дисков. 2017;10:2174. doi: 10.2174/1872213X11666170518114456. [PubMed] [CrossRef] [Академия Google]
52. Баламуруган В., Венкатесан Г., Бханупракаш В., Сингх Р.К. Верблюжья оспа, возникающее вирусное заболевание ортопокса. Индиан Дж. Вирол. 2013;3:295–305. doi: 10.1007/s13337-013-0145-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Oliveira G., Costa G., Assis F., Franco-Luiz A.P., Trindade G., Kroon E., Turrini F., Abrahão J. , Парапоксвирус. В: Лю Д., редактор. Молекулярное обнаружение вирусных патогенов животных. КПР Пресс; Бока-Ратон, Флорида, США: 2016. стр. 881–890. [Академия Google]
КПР Пресс; Бока-Ратон, Флорида, США: 2016. стр. 881–890. [Академия Google]
54. Mendez-Rios J.D., Martens C.A., Bruno D.P., Porcella S.F., Zheng Z.M., Moss B. Последовательность генома поксвируса, связанного с эритромелалгией, идентифицирует его как штамм вируса эктромелии. ПЛОС ОДИН. 2012;7:34604. doi: 10.1371/journal.pone.0034604. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Сигал Л. Дж. Патогенез и иммунобиология мышиной оспы. Доп. Иммунол. 2016; 129: 251–276. [PubMed] [Google Scholar]
56. Франко-Луис А.П., Оливейра Д.Б., Перейра А.Ф., Гаспарини М.К., Бонжардим К.А., Феррейра П.К., Триндади Г.С., Пуэнтес Р., Фуртадо А., Абрахао Дж.С. и др. Обнаружение вируса коровьей оспы в образцах сыворотки молочного скота с 2009 г., Уругвай. Эмердж. Заразить. Дис. 2016;22:2174–2177. doi: 10.3201/eid2212.160447. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
57. Friederichs S., Krebs S., Blum H., Lang H., Büttner M. Parapoxvirus (PPV) благородного оленя выявляет субклиническую инфекцию и подтверждает уникальный вид. Дж. Генерал Вирол. 2015;96:1446–1462. doi: 10.1099/vir.0.000080. [PubMed] [CrossRef] [Google Scholar]
Дж. Генерал Вирол. 2015;96:1446–1462. doi: 10.1099/vir.0.000080. [PubMed] [CrossRef] [Google Scholar]
58. Феннер Ф. Биологические характеристики нескольких штаммов вирусов осповакцины, коровьей и кроличьей оспы. Вирусология. 1958;5:502–529. doi: 10.1016/0042-6822(58)
-4. [PubMed] [CrossRef] [Google Scholar]
59. Геммелл А., Кэрнс Дж. Сцепление в геноме вируса животных. Вирусология. 1959; 8: 381–383. doi: 10.1016/0042-6822(59)
-6. [PubMed] [CrossRef] [Google Scholar]60. Sambrook J.F., Padgett B.L., Tomkins J.K. Условно-летальные мутанты вируса оспы кроликов. I. Выделение зависимых от клетки-хозяина и зависящих от температуры мутантов. Вирусология. 1966; 28: 592–599. doi: 10.1016/0042-6822(66)-3. [PubMed] [CrossRef] [Академия Google]
61. Феннер Ф., Сэмбрук Дж. Ф. Условно-летальные мутанты вируса кроличьей оспы. II. Мутанты (p), которые не могут размножаться в клетках PK-2a. Вирусология. 1966; 28: 600–609. doi: 10.1016/0042-6822(66)
-5. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]62. Ali A.N., Turner P.C., Brooks M.A., Moyer R.W. Ген SPI-1 вируса кроличьей оспы определяет круг хозяев и необходим для образования геморрагических очагов. Вирусология. 1994; 202:305–314. doi: 10.1006/viro.1994.1347. [PubMed] [CrossRef] [Академия Google]
63. Макклейн М.Е., Гренландия Р.М. Рекомбинация между мутантами вируса оспы кроликов в пермиссивных и непермиссивных клетках. Вирусология. 1965; 25: 516–522. doi: 10.1016/0042-6822(65)
-6. [PubMed] [CrossRef] [Google Scholar]64. Beattie E., Paoletti E., Tartaglia J. Различные модели чувствительности к IFN, наблюдаемые в клетках, инфицированных мутантными вирусами осповакцины K3L и E3L. Вирусология. 1965; 210: 254–263. doi: 10.1006/viro.1995.1342. [PubMed] [CrossRef] [Google Scholar]
65. Barrett J.W., Shun Chang C., Wang G., Werden S.J., Shao Z., Barrett C., Gao X., Belsito T.A., Villenevue D., McFadden G. Вирус миксомы M063R представляет собой ген диапазона хозяев, необходимый для репликации вируса в клетках кролика. Вирусология. 2007; 361: 123–132. doi: 10.1016/j.virol.2006.11.015. [PubMed] [CrossRef] [Академия Google]
Вирусология. 2007; 361: 123–132. doi: 10.1016/j.virol.2006.11.015. [PubMed] [CrossRef] [Академия Google]
66. Legrand F.A., Verardi P.H., Jones L.A., Chan K.S., Peng Y., Yilma T.D. Индукция мощных гуморальных и клеточно-опосредованных иммунных ответов аттенуированными векторами вируса осповакцины с делетированными серпиновыми генами. Дж. Вирол. 2004; 78: 2770–2779. doi: 10.1128/ОВИ.78.6.2770-2779.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Chang H.W., Jacobs B.L. Идентификация консервативного мотива, необходимого для связывания продуктов гена E3L вируса коровьей оспы с двухцепочечной РНК. Вирусология. 1993;194:537–547. doi: 10.1006/viro.1993.1292. [PubMed] [CrossRef] [Google Scholar]
68. Chang H.W., Watson J.C., Jacobs B.L. Ген E3L вируса коровьей оспы кодирует ингибитор интерферон-индуцированной двухцепочечной РНК-зависимой протеинкиназы. проц. Натл. акад. науч. США. 1992; 89: 4825–4829. doi: 10.1073/pnas.89.11.4825. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
69. Rivas C., Gil J., Melkova Z., Esteban M., Diaz-Guerra M. Белок E3L вируса коровьей оспы является ингибитором интерферона ( i.f.n.)-индуцированный фермент 2–5A-синтетаза. Вирусология. 1998;243:406–414. doi: 10.1006/viro.1998.9072. [PubMed] [CrossRef] [Google Scholar]
Rivas C., Gil J., Melkova Z., Esteban M., Diaz-Guerra M. Белок E3L вируса коровьей оспы является ингибитором интерферона ( i.f.n.)-индуцированный фермент 2–5A-синтетаза. Вирусология. 1998;243:406–414. doi: 10.1006/viro.1998.9072. [PubMed] [CrossRef] [Google Scholar]
70. Langland J.O., Kash J.C., Carter V., Thomas M.J., Katze M.G., Jacobs B.L. Подавление передачи провоспалительного сигнала и экспрессии генов двойными доменами связывания нуклеиновых кислот белков E3L вируса коровьей оспы. Дж. Вирол. 2006;80:10083–10095. doi: 10.1128/ОВИ.00607-06. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Davies M.V., Elroy-Stein O., Jagus R., Moss B., Kaufman R.J. Продукт гена вируса коровьей оспы K3L усиливает трансляцию путем ингибирования двухцепочечной РНК-активируемой протеинкиназы и фосфорилирования альфа-субъединицы эукариотического фактора инициации 2. J. Virol. 1992;66:1943–1950. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Davies M.V., Chang H. W., Jacobs B.L., Kaufman R.J. Генные продукты осповакцины E3L и K3L стимулируют трансляцию за счет ингибирования двухцепочечной РНК-зависимой протеинкиназы с помощью различных механизмов. Дж. Вирол. 1993; 67: 1688–1692. [Статья бесплатно PMC] [PubMed] [Google Scholar]
W., Jacobs B.L., Kaufman R.J. Генные продукты осповакцины E3L и K3L стимулируют трансляцию за счет ингибирования двухцепочечной РНК-зависимой протеинкиназы с помощью различных механизмов. Дж. Вирол. 1993; 67: 1688–1692. [Статья бесплатно PMC] [PubMed] [Google Scholar]
73. Craig A.W., Cosentino GP, Donze O., Sonenberg N. Киназный вставочный домен интерферон-индуцированной протеинкиназы PKR необходим для активности, но не для взаимодействия с псевдосубстратом. К3Л. Дж. Биол. хим. 1996;271:24526–24533. doi: 10.1074/jbc.271.40.24526. [PubMed] [CrossRef] [Google Scholar]
74. Kawagishi-Kobayashi M., Silverman J.B., Ung T.L., Dever T.E. Регуляция протеинкиназы PKR ингибитором псевдосубстрата вируса осповакцины K3L зависит от остатков, консервативных между белком K3L и субстратом PKR eIF2-альфа. Мол. Клетка. биол. 1997; 17:4146–4158. doi: 10.1128/MCB.17.7.4146. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Langland J.O., Jacobs B.L. Роль PKR-ингибирующих генов, E3L и K3L, в определении диапазона хозяев вируса коровьей оспы. Вирусология. 2002;299:133–141. doi: 10.1006/viro.2002.1479. [PubMed] [CrossRef] [Google Scholar]
Вирусология. 2002;299:133–141. doi: 10.1006/viro.2002.1479. [PubMed] [CrossRef] [Google Scholar]
76. Silverman G.A., Bird P.I., Carrell R.W., Church F.C., Coughlin P.B., Gettins P.G., Irving J.A., Lomas D.A., Luke C.J., Moyer R.W. структурно сходные, но функционально разные белки. Эволюция, механизм торможения, новые функции и пересмотренная номенклатура. Дж. Биол. хим. 2001; 276:33293–33296. doi: 10.1074/jbc.R100016200. [PubMed] [CrossRef] [Академия Google]
77. Эррера Э., Лоренцо М.М., Бласко Р., Исаакс С.Н. Функциональный анализ белка B5R вируса осповакцины: существенная роль в оболочке вируса не зависит от большой части внеклеточного домена. Дж. Вирол. 1998; 72: 294–302. [Статья бесплатно PMC] [PubMed] [Google Scholar]
78. Rodger G., Smith G.L. Замена доменов SCR белка B5R вируса коровьей оспы на EGFP вызывает уменьшение размера бляшки и образование актинового хвоста, но вирионы с оболочкой все еще транспортируются в поверхность клетки. Дж. Генерал Вирол. 2002; 83: 323–332. дои: 10.1099/0022-1317-83-2-323. [PubMed] [CrossRef] [Google Scholar]
дои: 10.1099/0022-1317-83-2-323. [PubMed] [CrossRef] [Google Scholar]
79. Spehner D., Gillard S., Drillien R., Kirn A. Ген вируса коровьей оспы необходим для размножения в клетках яичников китайского хомячка. Дж. Вирол. 1988; 62: 1297–1304. [Статья бесплатно PMC] [PubMed] [Google Scholar]
80. Chang S.J., Hsiao J.C., Sonnberg S., Chiang C.T., Yang M.H., Tzou DL, Mercer AA, Chang W. Белок хозяина поксвируса CP77 содержит F- коробчатый домен, который необходим для подавления активации NF-{каппа}B с помощью TNF-{альфа}, но не зависит от его функции диапазона хозяев. Дж. Вирол. 2009 г.;83:4140–4152. doi: 10.1128/ОВИ.01835-08. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
81. Meng X., Chao J., Xiang Y. Идентификация регуляторных генов диапазона хозяина из различных поксвирусов млекопитающих, функционирующих эквивалентно вирусу коровьей оспы C7L. Вирусология. 2008; 372: 372–383. doi: 10.1016/j.virol.2007.10.023. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Smith C.A., Davis T., Anderson D., Solam L., Beckmann M.P., Jerzy R., Dower S.K., Cosman D., Goodwin R.G. Рецептор фактора некроза опухоли определяет необычное семейство клеточных и вирусных белков. Наука. 1990;248:1019–1023. doi: 10.1126/science.2160731. [PubMed] [CrossRef] [Google Scholar]
Smith C.A., Davis T., Anderson D., Solam L., Beckmann M.P., Jerzy R., Dower S.K., Cosman D., Goodwin R.G. Рецептор фактора некроза опухоли определяет необычное семейство клеточных и вирусных белков. Наука. 1990;248:1019–1023. doi: 10.1126/science.2160731. [PubMed] [CrossRef] [Google Scholar]
83. Smith C.A., Davis T., Wignall J.M., Din W.S., Farrah T., Upton C., McFadden G., Goodwin R.G. Открытая рамка считывания T2 вируса фибромы Шоупа кодирует растворимую форму рецептора TNF. Биохим. Биофиз. Рез. коммун. 1991; 176: 335–342. doi: 10.1016/0006-291X(91)90929-2. [PubMed] [CrossRef] [Google Scholar]
84. Alejo A., Ruiz-Arguello M.B., Ho Y., Smith VP, Saraiva M., Alcami A. Хемокин-связывающий домен в рецепторе фактора некроза опухоли вируса натуральной оспы (оспа) вирус. проц. Натл. акад. науч. США. 2006;103:5995–6000. doi: 10.1073/pnas.0510462103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Дуглас А.Е., Корбетт К.Д., Бергер Дж.М., Макфадден Г. , Гендель Т.М. Структура M11L: структурный гомолог вируса миксомы ингибитора апоптоза, Bcl-2. Белковая наука. 2007; 16: 695–703. doi: 10.1110/ps.062720107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Гендель Т.М. Структура M11L: структурный гомолог вируса миксомы ингибитора апоптоза, Bcl-2. Белковая наука. 2007; 16: 695–703. doi: 10.1110/ps.062720107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Johnston J.B., Barrett J.W., Nazarian S.H., Goodwin M., Ricciuto D., Wang G., McFadden G. Белок пиринового домена, кодируемый поксвирусом взаимодействует с ASC-1, ингибируя воспалительные и апоптотические реакции хозяина на инфекцию. Иммунитет. 2005; 23: 587–59.8. doi: 10.1016/j.immuni.2005.10.003. [PubMed] [CrossRef] [Google Scholar]
87. Сенкевич Т.Г., Кунин Е.В., Бугерт Дж.Дж., Дараи Г., Мосс Б. Геном вируса контагиозного моллюска: анализ и сравнение с другими поксвирусами. Вирусология. 1997; 233:19–42. doi: 10.1006/viro.1997.8607. [PubMed] [CrossRef] [Google Scholar]
88. Хьюз А.Л., Ираускин С., Фридман Р. Эволюционная биология поксвирусов. Заразить. Жене. Эвол. 2010;10:50–59. doi: 10.1016/j.meegid.2009.10.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Айер Л.М., Аравинд Л., Кунин Е.В. Общее происхождение четырех разнообразных семейств крупных эукариотических ДНК-вирусов. Дж. Вирол. 2001;75:11720–11734. doi: 10.1128/ОВИ.75.23.11720-11734.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Айер Л.М., Аравинд Л., Кунин Е.В. Общее происхождение четырех разнообразных семейств крупных эукариотических ДНК-вирусов. Дж. Вирол. 2001;75:11720–11734. doi: 10.1128/ОВИ.75.23.11720-11734.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
90. Бойер М., Хименес Г., Сюзан-Монти М., Рауль Д. Классификация и определение возможного происхождения ОРС с помощью анализа большой ядерно-цитоплазматической ДНК вирусы. Интервирусология. 2010;53:310–320. doi: 10.1159/000312916. [PubMed] [CrossRef] [Академия Google]
91. Хьюз А.Л. Происхождение и эволюция вирусного интерлейкина-10 и других генов ДНК-вирусов с гомологами позвоночных. Дж. Мол. Эвол. 2002; 54: 90–101. doi: 10.1007/s00239-001-0021-1. [PubMed] [CrossRef] [Google Scholar]
92. Томпсон Дж.Д., Хиггинс Д.Г., Гибсон Т.Дж. CLUSTAL W: Повышение чувствительности последовательного множественного выравнивания за счет взвешивания последовательностей, штрафов за пробелы для конкретных позиций и выбора матрицы весов. Нуклеиновые Кислоты Res. 1994; 22:4673–4680. doi: 10.1093/нар/22.22.4673. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нуклеиновые Кислоты Res. 1994; 22:4673–4680. doi: 10.1093/нар/22.22.4673. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
93. Smithson C., Meyer H., Gigante C.M., Gao J., Zhao H., Batra D., Damon I., Upton C., Li Y. Два новых поксвируса с необычными перестройками генома: NY_014 и Murmansk. Гены вирусов. 2017 г.: 10.1007/s11262-017-1501-8. [PubMed] [CrossRef] [Google Scholar]
94. Вонг С.К., Янг В.Л., Клеффманн Т., Уорд В.К. Геномный и протеомный анализ иридовируса беспозвоночных 9 типа. J. Virol. 2011;85:7900–7911. doi: 10.1128/ОВИ.00645-11. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
95. Лежандр М., Сантини С., Рико А., Абергель С., Клавери Дж. М. Преодоление барьера в 1000 генов для мимивируса с использованием сверхглубокого секвенирования генома и транскриптома. Вирол. Дж. 2011; 8:99. doi: 10.1186/1743-422X-8-99. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
96. Odom M.R., Hendrickson R.C., Lefkowitz E.J. Эволюция белка поксвируса: семейная оценка возможных событий горизонтального переноса генов. Вирус рез. 2009; 144: 233–249. doi: 10.1016/j.virusres.2009.05.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эволюция белка поксвируса: семейная оценка возможных событий горизонтального переноса генов. Вирус рез. 2009; 144: 233–249. doi: 10.1016/j.virusres.2009.05.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
97. Гьессинг М.С., Ютин Н., Тенгс Т., Сенкевич Т., Кунин Э., Рённинг Х.П., Аларкон М., Илвинг С., Ли К.И., Сауре Б. Поксвирус лососевых жабр, глубочайший представитель хордопоксвирин . Дж. Вирол. 2015; 89: 9348–9367. doi: 10.1128/ОВИ.01174-15. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
98. O’Dea M., Tu S.-L., Pang S., De Ridder T., Jackson B., Upton C. Геномная характеристика нового поксвируса летучей лисицы: свидетельство существования нового рода? Дж. Генерал Вирол. 2016;97: 2363–2375. doi: 10.1099/jgv.0.000538. [PubMed] [CrossRef] [Google Scholar]
99. Tu S.L., Nakazawa Y., Gao J., Wilkins K., Gallardo-Romero N., Li Y., Emerson G.L., Carroll D.S., Upton C. Характеристика Eptesipoxvirus, новый поксвирус микрорукокрылых летучих мышей. Гены вирусов. 2017 г.: 10.1007/s11262-017-1485-4. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
Гены вирусов. 2017 г.: 10.1007/s11262-017-1485-4. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
100. Кунин Е.В., Сенкевич Т.Г., Доля В.В. Древний вирусный мир и эволюция клеток. биол. Прямой. 2006;1:29. дои: 10.1186/1745-6150-1-29. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
101. Барри М., Макфадден Г. Вирус, кодирующий цитокины и рецепторы цитокинов. Паразитология. 1997; 115: 89–100. doi: 10.1017/S0031182097001820. [PubMed] [CrossRef] [Google Scholar]
102. Лоуренс Дж. Г., Очман Х. Молекулярная археология генома Escherichia coli . проц. Натл. акад. науч. США. 1998;95:9413–9417. doi: 10.1073/pnas.95.16.9413. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
103. Очман Х., Лоуренс Дж.Г., Гройсман Э.А. Боковой перенос генов и природа бактериальных инноваций. Природа. 2000; 405: 299–304. doi: 10.1038/35012500. [PubMed] [CrossRef] [Google Scholar]
104. Upton C., McFadden G. Гомология последовательности ДНК между терминальными инвертированными повторами вируса фибромы Шоупа и эндогенными клеточными плазмидными видами. Мол. Клетка. биол. 1986; 6: 265–276. doi: 10.1128/MCB.6.1.265. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
Мол. Клетка. биол. 1986; 6: 265–276. doi: 10.1128/MCB.6.1.265. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
105. Liszewski M.K., Leung M.K., Hauhart R., Fang C.J., Bertram P., Atkinson J.P. Ингибитор оспы ферментов комплемента (SPICE): анализ функциональных сайтов и прекращение деятельности. Дж. Иммунол. 2009 г.;183:3150–3159. doi: 10.4049/jimmunol.0
6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
106. Ojha H., Panwar HS, Gorham RD, Morikis D., Sahu A. Вирусные регуляторы активации комплемента: структура, функция и эволюция. Мол. Иммунол. 2014;61:89–99. doi: 10.1016/j.molimm.2014.06.004. [PubMed] [CrossRef] [Google Scholar]
107. Котвал Г.Дж., Мосс Б. Анализ большого кластера несущественных генов, удаленных из мутанта терминальной транспозиции вируса коровьей оспы. Вирусология. 1988;167:524–537. doi: 10.1016/0042-6822(88)
-8. [PubMed] [CrossRef] [Google Scholar] 108. Котвал Г.Дж., Исаакс С.Н., Маккензи Р., Франк М.М. , Мосс Б. Ингибирование каскада комплемента основным секреторным белком вируса коровьей оспы. Наука. 1990; 250:827–830. doi: 10.1126/science.2237434. [PubMed] [CrossRef] [Google Scholar]
, Мосс Б. Ингибирование каскада комплемента основным секреторным белком вируса коровьей оспы. Наука. 1990; 250:827–830. doi: 10.1126/science.2237434. [PubMed] [CrossRef] [Google Scholar]
Сердечно-сосудистые исследования и публикации | Тампа Кардиоваскуляр
Саданандан С. , Шеррид М.В. Клинико-эхокардиографические характеристики спонтанного эхоконтрастирования при синусовом ритме. Тираж 1998 Дополнение (аннотация)
Sadanandan S , Lamas G, Hochman JS et al для исследователей OAT. Ангиографические характеристики и лечение окклюзированных артерий, связанных с инфарктом, после острого инфаркта миокарда — результаты из реестра исследований открытых артерий. Журнал Американского колледжа кардиологов, 33 февраля 1999 г. (приложение A): 379A
Sadanandan S , Azadpur M, Aziz E, Tamis J и Slater JN. Клинические и ангиографические предикторы высвобождения КФК после имплантации стента при ишемической болезни сердца.
Тадани У и Саданандан С . Отсутствие положительного эффекта внутривенных ингибиторов рецепторов тромбоцитов гликопротеина IIb/IIIa у пациентов с острым коронарным синдромом: время пересмотреть их рутинное использование. J Am Coll Cardiol 2001 Feb; 32 No.2 (приложение A): 366A
Sadanandan S , Hochman JS, Criger DA, Ross AM, Wagner GS. Значение комбинированной передней и нижней элевации ST у пациентов с острым инфарктом миокарда. Научная конференция по молекулярным, интегративным и клиническим подходам к ишемии миокарда. Сиэтл, Вашингтон. AHA Abstracts 2001 Aug. P87
Sadanandan S , Cannon CP, Dibattiste PM, Robertson D, Kugelmass AD, для исследователей TACTICS TIMI-18. Исходы у пациентов со спонтанным повышением CK-MB по сравнению с пост-ЧКВ: данные исследования TACTICS TIMI-18. Тираж 2001:104: Дополнение II; 697
Kugelmass AD, Sadanandan S , Cannon CP, Dibattiste PM, Robertson D, Braunwald E, для исследователей TACTICS TIMI-18. Ранняя инвазивная стратегия улучшает исходы у пациентов с острым коронарным синдромом, ранее перенесших АКШ: результаты исследования TACTICS TIMI-18. Тираж 2001:104: Дополнение II;548
Ранняя инвазивная стратегия улучшает исходы у пациентов с острым коронарным синдромом, ранее перенесших АКШ: результаты исследования TACTICS TIMI-18. Тираж 2001:104: Дополнение II;548
Кугельмасс А, Саданандан С . Острый инфаркт миокарда, кардиогенный шок и пожилой возраст, имеет ли значение реваскуляризация? 3-й Научный форум по исследованию качества медицинской помощи и результатов при сердечно-сосудистых заболеваниях и инсульте: тезисы публикации. Am Heart J октябрь 2001 г.
Kugelmass A, Sadanandan S . Благоприятный эффект реваскуляризации у пожилых больных с кардиогенным шоком. J Am Coll Cardiol Mar; 39 № 5 (дополнение A): 292A
Sadanandan S , Вираппан Б., Шехтер Э., Гани М., Хеннебри Т., Сауседо Дж., Блик К. Проспективное исследование для оценки адекватности антикоагулянтной терапии при чрескожных коронарных вмешательствах у пациентов с острыми коронарными синдромами, которым проводится ранняя ангиография с подкожным введением эноксапарина. J Am Coll Cardiol 2004:43:31A
J Am Coll Cardiol 2004:43:31A
Sadanandan S , Lazzara R, Desai R, Patel A, Vesely S, Schechter E, Sivaram CA, Kugelmass A, Thadani U. Рутинное восходящее и селективное использование гликопротеина в лаборатории Ингибитор 2B-3A у пациентов с высоким риском и ОКС без подъема сегмента ST, управляемых с помощью ранней инвазивной стратегии. Ам Дж Кардиол 2004;94 (дополнение): 39E
Sadanandan S , Steinberg JS. Ишемический некроз кожи: осложнение имплантации ИКД. Heartweb Vol: 2 No: 5 March 1997
Sadanandan S , Sherrid MV. Клинико-эхокардиографические характеристики спонтанного эхоконтрастирования при синусовом ритме. J Am Coll Cardiol 2000; 35:1932-1938.
Саданандан С. , Стейнберг Дж.С. Усредненный сигнал зубца P: техника и клиническое применение. Анналы неинвазивной электрокардиологии. 1999;4(4):401-407
Саданандан С. и Хохман Дж.С. Ранняя реперфузия, поздняя реперфузия и гипотеза открытой артерии: обзор. Prog Cardiovasc Dis. 2000;42:397-404
Prog Cardiovasc Dis. 2000;42:397-404
Саданандан С. , Буллер С., Менон В. Дзавик В., Террин М., Томпсон Б., Хохман Дж.С. Поздняя открытая артерия — десятилетие спустя. Am Heart J 2001, сентябрь; 142(3):411-421
Стейнберг Дж.С., Мартинс Дж., Саданандан С. , Голднер Б., Менчавес Э., Дома Руссо А., Тулло Н., Халльстрем А.; следователи AVID. Использование антиаритмических препаратов в группе имплантируемых дефибрилляторов в исследовании антиаритмических препаратов по сравнению с имплантируемыми дефибрилляторами (AVID). Am Heart J 2001 Сентябрь; 142 (3): 520-529
Pahlm-Webb U, Pahlm O, Sadanandan S , Selvester R, Wagner GS. Новый метод использования направления отклонения сегмента ST для локализации очага острой коронароокклюзии: стандартная ЭКГ в 24 проекциях. Am J Med 2002 июль; 113(1):75-8
Саданандан С. , Хохман Дж.С., Колодзей А., Кригер Д.А., Росс А., Селвестер Р., Вагнер Г.С. Клинико-ангиографическая характеристика пациентов с комбинированным отклонением переднего и нижнего сегмента ST на исходной электрокардиограмме при остром инфаркте миокарда. Am Heart J 2003; 146: 653-61
Am Heart J 2003; 146: 653-61
Вираппан Б., Латиф Ф., Патибандла С., Хеннебри Т., Гани М., Сауседо Дж., Шехтер Э., Саданандан С. . Первичное ЧКВ по поводу инфаркта миокарда с подъемом сегмента ST у пациента, получавшего подкожное введение эноксапарина с использованием теста Enox в месте оказания медицинской помощи. J Инвазивная кардиол. 2003 May;15(5):4p
Weintraub WS, Sadanandan S . Чрескожное коронарное вмешательство у стабильных больных после острого инфаркта миокарда. Тираж. 2003;108(11):1292-4.
Фахди И.Е., Сауседо Дж.Ф., Хеннебри Т., Гани М., Sadanandan S , Garza-Arreola L. Частота и динамика тромбоцитопении при применении абциксимаба и эптифибатида у пациентов, перенесших чрескожное коронарное вмешательство. Ам Джей Кардиол. 2004 г., 15 февраля; 93 (4): 453-5.
Sadanandan S , Cannon CP, Gibson CM, Desai R, Murphy SA, DiBattiste PM, Braunwald E. Оценка риска для прогнозирования операции аортокоронарного шунтирования у пациентов с острыми коронарными синдромами без подъема сегмента ST. J Am Coll Cardiol 2004; 44:799–803.
J Am Coll Cardiol 2004; 44:799–803.
Саданандан С , Кэннон С.П., Чеури К., Мерфи С.А., ДиБаттисте П.М., Морроу Д.А., де Лемос Д.А., Браунвальд Э., Гибсон К.М. Ассоциация повышенных уровней натрийуретического пептида В-типа с ангиографическими данными у пациентов с нестабильной стенокардией и инфарктом миокарда без подъема сегмента ST. J Am Coll Cardiol 2004; 44:564–8
Саданандан С . Предсказывают ли уровни натрийуретического пептида типа В в сыворотке краткосрочную смертность и ангиографический успех? Nat Clin Pract Cardiovasc Med. 2005 февраль;2(2):72-3.
Кугельмасс АД, Sadanandan S , Lakkis N, Dibattiste PM, Robertson DH, Demopoulos LA, Gibson CM, Weintraub WS, Murphy SA, Cannon CP; Ранняя инвазивная стратегия улучшает исходы у пациентов с острым коронарным синдромом, перенесших операцию аортокоронарного шунтирования в анамнезе: отчет исследователей TACTICS-TIMI 18. CritPathwКардиол. 2006 г., сен; 5 (3): 167–72.
Сингх И.М., Суббарао Р.А., Саданандан С. Ограничение фракционного резерва потока при оценке моста миокарда коронарной артерии. J Invasive Cardiol2008:20;E161-6
Сингх, И. М.; Антун, PS; Шумейкер, Т.Дж.; Колин Т; Кво, ПЯ; Тектор Дж.А.; Брилл Дж. А.; Саданандан, S . Катетеризация сердца как стратегия предоперационной стратификации риска у пациентов, перенесших трансплантацию печени. Тираж. 2008; 118: S903-S904
Антун, П.С.; Сингх, И. М.; Колин Т; Шумейкер, Т.Дж.; Кво, ПЯ; Бреалл, Дж. А.; Саданандан, S . Предоперационная легочная гипертензия и смертность у пациентов, перенесших трансплантацию печени. Абстрактная презентация. 32-я ежегодная научная сессия Общества сердечно-сосудистой ангиографии и вмешательств (SCAI) в Лас-Вегасе с 6 по 9 мая., 2009
Болад И.А., Хан Б., Вондерлоэ Э., Саданандан С. , Бреалл Дж.А. Сердечные события после внесердечных операций у пациентов с предшествующим коронарным вмешательством в эпоху стентов с лекарственным покрытием. J Invasive Cardiol 2011:23;283-6
J Invasive Cardiol 2011:23;283-6
Аггарвал А, Ревтяк Г, Саданандан С . Фармакологическая Тромбэктомия с суперселективным внутриочаговым введением абциксимаба у пациентов с ИМпST – это новый стандарт лечения? Абстрактная презентация. Euro-PCR Paris, 2012. Закрытие или медикаментозная терапия криптогенного инсульта с открытым овальным окном. ЗАВЕРШЕНИЕ I Следователи. Фурлан А.Дж., Райсман М., Массаро Дж., Маури Л., Адамс Х., Альберс Г.В., Фельберг Р., Херрманн Х., Кар С., Ландзберг М., Райзнер А., Векслер Л.; N Engl J Med. 2012 15 марта; 366(11):991-9
FREEDOM Судебные следователи. Стратегии многососудистой реваскуляризации у больных сахарным диабетом. Фарку М.Э., Домански М., Слипер Л.А., Сиами Ф.С., Дангас Г., Мак М., Ян М., Коэн Д.Дж., Розенберг Ю., Соломон С.Д., Десаи А.С., Герш Б.Дж., Магнусон Э.А., Лански А., Буано Р., Вайнбергер Дж., Раманатан К. , Соуза Дж. Э., Рэнкин Дж., Бхаргава Б., Бус Дж., Хьюб В., Смит Ч. Р., Муратов В., Бансилал С., Кинг С. 3-й, Бертран М., Фустер В. ;. N Engl J Med. 20 декабря 2012 г .; 367 (25): 2375-84
3-й, Бертран М., Фустер В. ;. N Engl J Med. 20 декабря 2012 г .; 367 (25): 2375-84
Ансари, Х и Саданандан, С . Аллергическая реакция на устройство Amplatzer для чрескожного введения при симптоматическом открытом овальном отверстии. J Clin Case Rep 2013, 3:12
АКТИВНЫЕ следователи. Устойчивая проходимость и клиническое улучшение после лечения атеросклеротического поражения подвздошных артерий с использованием кобальтовой подвздошной баллонно-расширяемой системы стентов Assurant. Молнар Р.Г., Грей В.А.; J EndovascTher. 2013 Feb; 20 (1): 94-103. Ансари, Х и Саданандан, С . Чрескожная поддержка с помощью устройства TandemHeart при постинфарктном разрыве межжелудочковой перегородки и кардиогенном шоке: новая парадигма лечения? Дайджест лаборатории катетеризации. Том 22: Выпуск 2: февраль 2014 г.
Лэрд Дж. Р., Джайн А., Зеллер Т., Фельдман Р., Шейнерт Д., Попма Дж. Дж., Армстронг Э. Дж., Джафф М. Р.; Полные следователи SE. Имплантация нитинолового стента в поверхностную бедренную артерию и проксимальную часть подколенной артерии: результаты полного многоцентрового исследования SE за 12 месяцев.
 .
26
27
28
29 ..
.
26
27
28
29 ..
 **
** Компания Versatile предлагает на выбор шины компа-
Компания Versatile предлагает на выбор шины компа- **
**